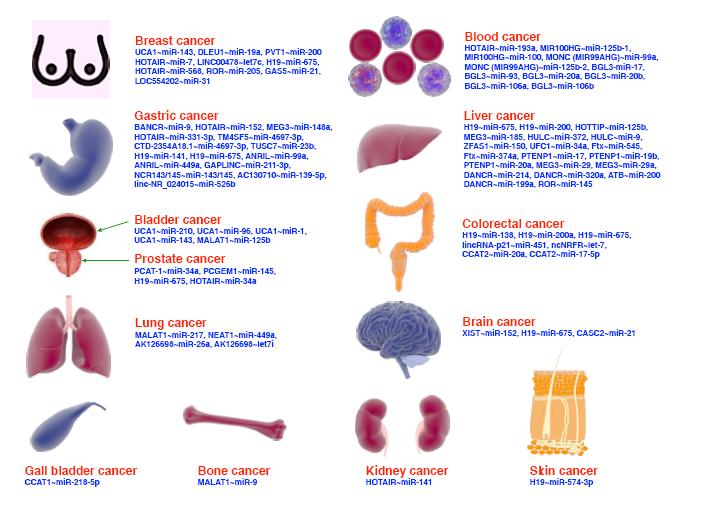
| 1. |
Yuan MW, Wang HH, Duan RF, et al. Analysis on cancer incidence and mortality attributed to human papillomavirus infection in China, 2016. Zhonghua Liu Xing Bing Xue Za Zhi, 2022, 43(5): 702-708.
|
| 2. |
Herbst RS, Heymach JV, Lippman SM. Lung cancer. N Engl J Med, 2008, 359(13): 1367-1380.
|
| 3. |
Noone A, Howlader N, Krapcho M, et al. SEER cancer statistics review, 1975-2015. National Cancer Institute. Bethesda, April 2018. https://seer.cancer.gov/archive/csr/1975_2015/. Access on 2022-04-11.
|
| 4. |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: Proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol, 2016, 11(1): 39-51.
|
| 5. |
中國抗癌協會肺癌專業委員會, 中華醫學會腫瘤學分會肺癌學組. Ⅲ期非小細胞肺癌多學科診療專家共識(2019版). 中華腫瘤雜志, 2019, 41(12): 881-890.
|
| 6. |
Tan WL, Chua KLM, Lin CC, et al. Asian Thoracic Oncology Research Group expert consensus statement on optimal management of stage Ⅲ NSCLC. J Thorac Oncol, 2020, 15(3): 324-343.
|
| 7. |
Suzuki S, Goto T. Role of surgical intervention in unresectable non-small cell lung cancer. J Clin Med, 2020, 9(12): 3881.
|
| 8. |
Shafer AD, Selinkoff PM. Preoperative irradiation and chemotherapy for initially unresectable hepatoblastoma. J Pediatr Surg, 1977, 12(6): 1001-1007.
|
| 9. |
Tang ZY, Yu YQ, Zhou XD, et al. Treatment of unresectable primary liver cancer: With reference to cytoreduction and sequential resection. World J Surg, 1995, 19(1): 47-52.
|
| 10. |
Roswit B, Patno ME, Rapp R, et al. The survival of patients with inoperable lung cancer: A large-scale randomized study of radiation therapy versus placebo. Radiology, 1968, 90(4): 688-697.
|
| 11. |
Dillman RO, Seagren SL, Propert KJ, et al. A randomized trial of induction chemotherapy plus high-dose radiation versus radiation alone in stage Ⅲ non-small-cell lung cancer. N Engl J Med, 1990, 323(14): 940-945.
|
| 12. |
Fournel P, Robinet G, Thomas P, et al. Randomized phase Ⅲ trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced non-small-cell lung cancer: Groupe Lyon-Saint-Etienne d'Oncologie Thoracique-Groupe Fran?ais de Pneumo-Cancérologie NPC 95-01 Study. J Clin Oncol, 2005, 23(25): 5910-5917.
|
| 13. |
Curran WJ, Paulus R, Langer CJ, et al. Sequential vs. concurrent chemoradiation for stage Ⅲ non-small cell lung cancer: Randomized phase Ⅲ trial RTOG 9410. J Natl Cancer Inst, 2011, 103(19): 1452-1460.
|
| 14. |
Aupérin A, Le Péchoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol, 2010, 28(13): 2181-2190.
|
| 15. |
Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small-cell lung cancer: A phase Ⅲ randomised controlled trial. Lancet, 2009, 374(9687): 379-386.
|
| 16. |
Liu Y, Dong Y, Kong L, et al. Abscopal effect of radiotherapy combined with immune checkpoint inhibitors. J Hematol Oncol, 2018, 11(1): 104.
|
| 17. |
Wang Y, Deng W, Li N, et al. Combining immunotherapy and radiotherapy for cancer treatment: Current challenges and future directions. Front Pharmacol, 2018, 9: 185.
|
| 18. |
Zhou L, Xu Q, Huang L, et al. Low-dose carboplatin reprograms tumor immune microenvironment through STING signaling pathway and synergizes with PD-1 inhibitors in lung cancer. Cancer Lett, 2021, 500: 163-171.
|
| 19. |
Spigel DR, Faivre-Finn C, Gray JE, et al. Five-year survival outcomes from the PACIFIC trial: Durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer. J Clin Oncol, 2022, 40(12): 1301-1311.
|
| 20. |
Jung HA, Noh JM, Sun JM, et al. Real world data of durvalumab consolidation after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer. Lung Cancer, 2020, 146: 23-29.
|
| 21. |
Bryan DS, Donington JS. The role of surgery in management of locally advanced non-small cell lung cancer. Curr Treat Options Oncol, 2019, 20(4): 27.
|
| 22. |
Wu KL, Jiang GL, Qian H, et al. Three-dimensional conformal radiotherapy for locoregionally recurrent lung carcinoma after external beam irradiation: A prospective phase Ⅰ-Ⅱ clinical trial. Int J Radiat Oncol Biol Phys, 2003, 57(5): 1345-1350.
|
| 23. |
Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage ⅢA orⅢB non-small-cell lung cancer (RTOG 0617): A randomised, two-by-two factorial phase 3 study. Lancet Oncol, 2015, 16(2): 187-199.
|
| 24. |
Fowler WC, Langer CJ, Curran WJ, et al. Postoperative complications after combined neoadjuvant treatment of lung cancer. Ann Thorac Surg, 1993, 55(4): 986-989.
|
| 25. |
Eberhardt W, Wilke H, Stamatis G, et al. Preoperative chemotherapy followed by concurrent chemoradiation therapy based on hyperfractionated accelerated radiotherapy and definitive surgery in locally advanced non-small-cell lung cancer: Mature results of a phase Ⅱ trial. J Clin Oncol, 1998, 16(2): 622-634.
|
| 26. |
Romero-Vielva L, Viteri S, Moya-Horno I, et al. Salvage surgery after definitive chemo-radiotherapy for patients with non-small cell lung cancer. Lung Cancer, 2019, 133: 117-122.
|
| 27. |
Eberhardt WE, P?ttgen C, Gauler TC, et al. Phase Ⅲ study of surgery versus definitive concurrent chemoradiotherapy boost in patients with resectable stage ⅢA(N2) and selected Ⅲb non-small-cell lung cancer after induction chemotherapy and concurrent chemoradiotherapy (ESPATUE). J Clin Oncol, 2015, 33(35): 4194-4201.
|
| 28. |
Aokage K, Tsuboi M, Zenke Y, et al. Study protocol for JCOG1807C (DEEP OCEAN): A interventional prospective trial to evaluate the efficacy and safety of durvalumab before and after operation or durvalumab as maintenance therapy after chemoradiotherapy against superior sulcus non-small cell lung cancer. Jpn J Clin Oncol, 2022, 52(4): 383-387.
|
| 29. |
Faivre-Finn C, Vicente D, Kurata T, et al. Four-year survival with durvalumab after chemoradiotherapy in stage Ⅲ NSCLC: An update from the PACIFIC trial. J Thorac Oncol, 2021, 16(5): 860-867.
|
| 30. |
Aredo JV, Mambetsariev I, Hellyer JA, et al. Durvalumab for stage Ⅲ EGFR-mutated NSCLC after definitive chemoradiotherapy. J Thorac Oncol, 2021, 16(6): 1030-1041.
|
| 31. |
Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med, 2018, 378(2): 113-125.
|
| 32. |
Hishida T, Nagai K, Mitsudomi T, et al. Salvage surgery for advanced non-small cell lung cancer after response to gefitinib. J Thorac Cardiovasc Surg, 2010, 140(5): e69-e71.
|
| 33. |
Zhang C, Li SL, Nie Q, et al. Neoadjuvant crizotinib in resectable locally advanced non-small cell lung cancer with ALK rearrangement. J Thorac Oncol, 2019, 14(4): 726-731.
|
| 34. |
Li K, Cao X, Ai B, et al. Salvage surgery following downstaging of advanced non-small cell lung cancer by targeted therapy. Thorac Cancer, 2021, 12(15): 2161-2169.
|
| 35. |
Liang W, Cai K, Chen C, et al. Expert consensus on neoadjuvant immunotherapy for non-small cell lung cancer. Transl Lung Cancer Res, 2020, 9(6): 2696-2715.
|
| 36. |
Bott MJ, Cools-Lartigue J, Tan KS, et al. Safety and feasibility of lung resection after immunotherapy for metastatic or unresectable tumors. Ann Thorac Surg, 2018, 106(1): 178-183.
|
| 37. |
Provencio M, Nadal E, Insa A, et al. Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer (NADIM): An open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol, 2020, 21(11): 1413-1422.
|
| 38. |
Provencio M, Nadal E, Insa A, et al. OA20.01 Long term survival in operable stage Ⅲa NSCLC patients treated with neoadjuvant nivolumab plus chemotherapy: NADIM study. J Thorac Oncol, 2021, 16(10): S883.
|
| 39. |
Spicer J, Wang C, Tanaka F, et al. Surgical outcomes from the phase 3 CheckMate 816 trial: Nivolumab (NIVO)+platinum-doublet chemotherapy (chemo) vs. chemo alone as neoadjuvant treatment for patients with resectable non-small cell lung cancer (NSCLC). J Clin Oncol, 2021, 39(15_suppl): 8503.
|
| 40. |
Kawai H, Saito Y, Demura R, et al. Case of advanced pulmonary squamous cell carcinoma cured by resection through preoperative induction of immune checkpoint inhibitor. Thorac Cancer, 2018, 9(4): 495-497.
|
| 41. |
Lin CP, Sung YC, Lo CY, et al. Pathological complete response of initially inoperable lung squamous cell carcinoma treated by immunochemotherapy: A case report. Asian J Surg, 2020, 43(1): 393-395.
|
| 42. |
Zheng Y, Zhu W, Huang X, et al. Neoadjuvant immunotherapy combined with chemotherapy for locally advanced squamous cell lung carcinoma: A case report and literature review. Open Life Sci, 2021, 16(1): 838-844.
|
| 43. |
Saito S, Toyokawa G, Momosaki S, et al. Dramatic response to pembrolizumab with chemotherapy followed by salvage surgery in a lung cancer patient. Thorac Cancer, 2021, 12(15): 2217-2220.
|
| 44. |
Chen T, Ning J, Campisi A, et al. Neoadjuvant PD-1 inhibitors and chemotherapy for locally advanced NSCLC: A retrospective study. Ann Thorac Surg, 2022, 113(3): 993-999.
|
| 45. |
Deng H, Liu J, Cai X, et al. Radical minimally invasive surgery after immuno-chemotherapy in initially-unresectable stage ⅢB non-small cell lung cancer. Ann Surg, 2022, 275(3): e600-e602.
|
| 46. |
Boch T, Frost N, Sommer L, et al. Pathologic responses in oligometastatic NSCLC patients treated with neoadjuvant immune checkpoint blockade with and without chemotherapy followed by surgery. Lung Cancer, 2022, 164: 46-51.
|